Å kunne balansere kjemiske reaksjonslikninger er helt avgjørende for å forstå og regne på kjemiske reaksjoner. I denne artikkelen går vi gjennom hva balansering betyr, hvorfor det er viktig, og hvordan du går frem i praksis – med konkrete eksempler underveis.
Hvorfor må reaksjonslikninger balanseres?
Når et stoff reagerer med et annet, dannes nye stoffer, men ingen atomer forsvinner eller oppstår i en kjemisk reaksjon – de bare omorganiseres.
Derfor må vi sørge for at det er samme antall av hvert atom på begge sider av reaksjonspilen. Det er dette vi kaller balansering av reaksjonslikninger.
En ubalansert likning betyr at vi ikke har tatt hensyn til alle atomene i reaksjonen. Det gjør videre beregninger (for eksempel i støkiometri) feil – og det vil vi unngå. betaler hver termin.
Slik tenker du når du balanserer
Å balansere reaksjonslikninger handler ikke om å pugge regler, men om å se mønstre. Det finnes ingen universell oppskrift som fungerer i alle situasjoner, men du kommer langt med systematikk og litt prøving og feiling.
Et godt tips er å:
- Telle antall atomer av hvert grunnstoff på begge sider.
- Starte med grunnstoffer som bare forekommer i ett stoff på hver side.
- Avslutte med oksygen og hydrogen, fordi de ofte forekommer i flere forbindelser.
- Bruke støkiometriske koeffisienter (tall foran molekylene) for å balansere antall atomer.
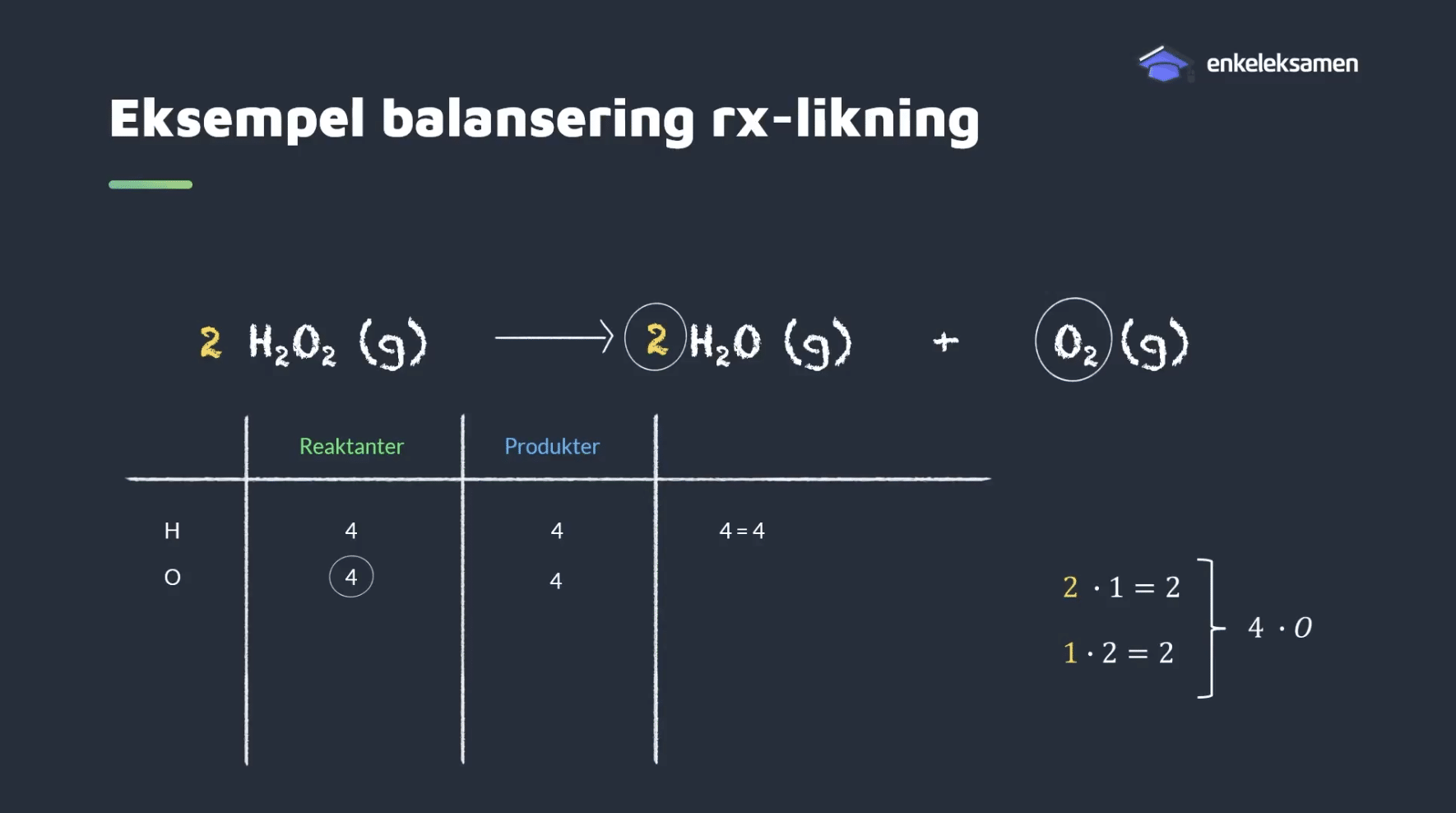
Eksempel 1: Spalting av hydrogenperoksid
La oss se på et enkelt eksempel:
H₂O₂(g) H₂O(g) + O₂(g)
Trinn 1: Tell atomer

- Venstre side: 2 H, 2 O
- Høyre side: 2 H, 3 O
→ Ikke balansert (flere oksygen på høyre side).
Trinn 2: Prøv å balansere oksygen
Setter vi 2 foran H₂O₂, får vi:
2H₂O₂(g) H₂O(g) + O₂(g)
Nå har vi 4 H og 4 O på venstre side.
Trinn 3: Balansér hydrogen
Setter vi 2 foran H₂O, får vi:
2H₂O₂(g) 2H₂O(g) + O₂(g)
→ 4 H og 4 O på begge sider.
Likningen er balansert!
Eksempel 2: Forbrenning av propan (C₃H₈)
Forbrenningsreaksjoner kan virke litt mer kompliserte, men prinsippet er det samme.
C₃H₈ + O₂ CO₂ + H₂O
Trinn 1: Start med karbon
Det er 3 karbonatomer i propan, så vi setter 3 foran CO₂:
C₃H₈ + O₂ 3CO₂ + H₂O
Trinn 2: Balansér hydrogen
Propan har 8 hydrogenatomer. Det tilsvarer 4 H₂O-molekyler:
C₃H₈ + O₂ 3CO₂ + 4H₂O
Trinn 3: Balansér oksygen
På høyre side har vi totalt 10 oksygenatomer (6 fra CO₂ + 4 fra H₂O).
Da må vi ha 5 O₂-molekyler på venstre side:
C₃H₈ + 5O₂ 3CO₂ + H₂O
→ Nå er det 3 C, 8 H og 10 O på begge sider.
Likningen er balansert!
Molforhold i balanserte likninger

Når du balanserer, finner du samtidig molforholdet mellom stoffene i reaksjonen.
For propanreaksjonen betyr likningen at:
- 1 mol propan reagerer med 5 mol oksygengass
- og danner 3 mol karbondioksid og 4 mol vann.
Dette molforholdet er helt nødvendig når du senere skal gjøre beregninger i kjemi, for eksempel for å finne ut hvor mye produkt som dannes, eller hvor mye reaktant som trengs.
Vi har også flere andre artikler hvor du kan lære om sentrale temaer innenfor faget kjemi.
Vil du lære mer om reaksjonslikninger og Kjemi 1?
Dette var bare en introduksjon til reaksjonslikninger og hvordan den fungerer. I vårt digitale undervisningsopplegg finner du komplette videoleksjoner, forklaringer og oppgaver som hjelper deg å forstå hele pensum. Du kan prøve faget gratis og se selv hvordan vi gjøre kjemi 1 enklere og mer oversiktlig.
Ønsker du å lære mer? Sjekk ut våre fag og undervisning i Kjemi 1!

REA3045
Kjemi 1 – VGS

REA3045
Kjemi 1 – Privatist