pH er et grunnleggende begrep i kjemi, og brukes for å beskrive hvor sur eller basisk en løsning er. Men hva betyr egentlig det – og hvordan finner vi ut hvilken pH-verdi en løsning har?
I denne artikkelen forklarer vi hva pH er, hvordan skalaen fungerer, og hvordan du kan beregne eller måle pH i praksis.
Hva betyr pH?
pH er et mål på konsentrasjonen av hydrogenioner (H⁺) i en løsning. Jo flere H⁺-ioner løsningen inneholder, desto surere er den.
Skalaen for pH går fra 0 til 14, og deles inn slik:
- pH < 7: Løsningen er sur
- pH = 7: Løsningen er nøytral
- pH > 7: Løsningen er basisk
Eksempler på pH-verdier
- Sitronsaft (sur løsning): ca. pH 3
- Rent vann (nøytral løsning): pH 7
- Ammoniakk (basisk løsning): pH 11–12
En logaritmisk skala
pH-skalaen er logaritmisk, noe som betyr at hver enhet representerer en tidobling i surhet eller basicitet.
For eksempel:
En løsning med pH 4 er 10 ganger surere enn en løsning med pH 5.
Formelen for pH uttrykkes slik:
pH = −log[H⁺]
Her står [H⁺] for konsentrasjonen av hydrogenioner i mol per liter.
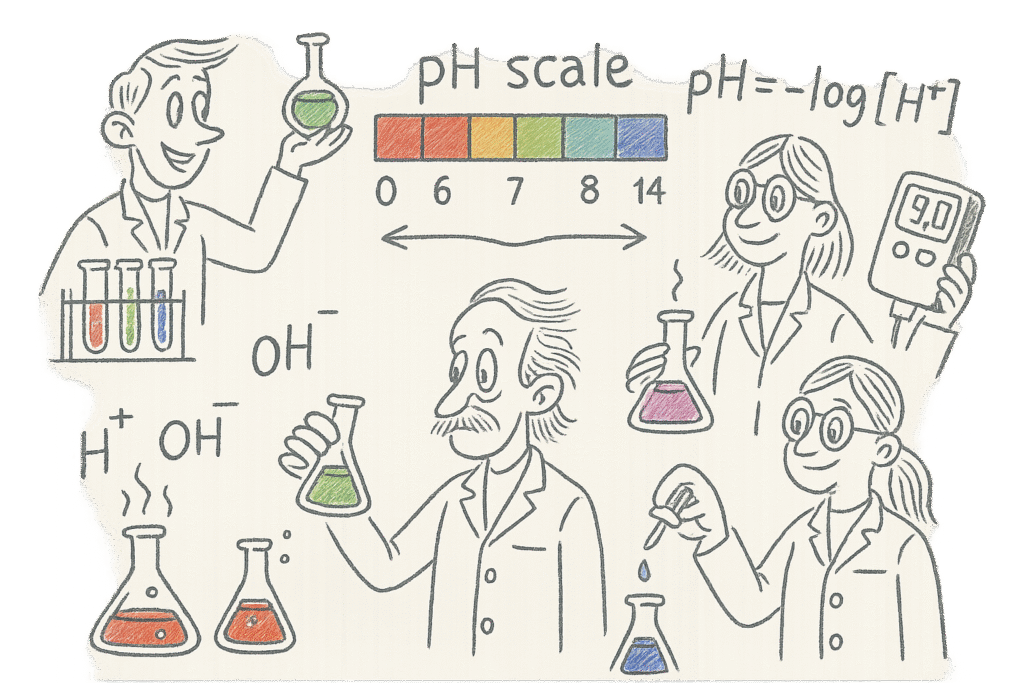
Beregning av pH i syrer og baser
Syrer
Syrer spaltes i vann og frigir H⁺-ioner.
For syrer kan vi derfor finne pH direkte ved å bruke konsentrasjonen av H⁺ i formelen over.
Altså:
pH = −log[H⁺]
Baser
Baser fungerer motsatt: de øker konsentrasjonen av hydroksidioner (OH⁻) i en løsning. For baser bruker vi derfor først pOH, som beregnes slik:
pOH = −log[OH⁻]
Sammenhengen mellom pH og pOH er:
pH + pOH = 14
Når du har funnet pOH, kan du enkelt finne pH ved å trekke pOH-verdien fra 14.
Hvordan måle pH i praksis
I tillegg til beregninger kan pH måles eksperimentelt ved hjelp av indikatorer. En indikator er et stoff som endrer farge ved bestemte pH-verdier, og gir dermed et visuelt inntrykk av om løsningen er sur, nøytral eller basisk.
Eksempler på vanlige indikatorer:
- Fenolftalein: Fargeløs i sur løsning, men blir rosa i basisk løsning.
- Bromtymolblått (BTB): Gul i sur løsning, grønn ved nøytral pH og blå i basisk løsning.
Indikatorer brukes ofte i laboratoriet for å finne omtrentlige pH-verdier, mens mer nøyaktige målinger gjøres med et pH-meter.
Oppsummering
Gjennom eksemplet med hjortebestanden har vi sett hvordan pH måler konsentrasjonen av hydrogenioner (H⁺) i en løsning.
- Skalaen går fra 0 til 14, der 7 er nøytralt.
- Syrer har lav pH, baser har høy pH
- pH-skalaen er logaritmisk – en forskjell på én pH-enhet betyr en tidobling i surhet.
- pH og pOH henger sammen: pH + pOH = 14.
- pH kan bestemmes både gjennom beregning og ved hjelp av indikatorer eller pH-meter.
Kort sagt:
pH forteller oss hvor surt eller basisk et stoff er – en helt sentral egenskap i kjemien, med betydning for alt fra kroppens biokjemi til miljø og industri.

Vi har også flere andre artikler hvor du kan lære om sentrale temaer innenfor faget Kjemi 1.
Vil du lære mer om pH og Kjemi 1?
Dette var bare en introduksjon til pH. I vårt digitale undervisningsopplegg finner du komplette videoleksjoner, forklaringer og oppgaver som hjelper deg å forstå hele pensum. Du kan prøve faget gratis og se selv hvordan vi gjør Kjemi 1 enklere og mer oversiktlig.
Ønsker du å lære mer? Sjekk ut våre fag og undervisning i Kjemi 1!

REA3045
Kjemi 1 – VGS

REA3045
Kjemi 1 – Privatist